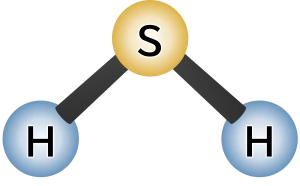
硫化水素(H2S)分子がなぜ折れ線形を取るのか、その科学的原理は何でしょうか?
また、直線形と折れ線形の分子をどのように見分けることができるのでしょうか?
ポイント先取り:H₂Sは中心の硫黄(S)に孤立電子対が2組あるため、 立体配置は四面体、見える形は折れ線形(曲がった形)になります。各S–H結合の極性の矢印が打ち消し合わず、分子全体も極性をもちます。
H₂Sの基礎データ(サッと確認)
| 項目 | 値・メモ |
|---|---|
| 化学式 | H₂S |
| 価電子(S/H) | S: 6、H: 1 |
| 孤立電子対(S上) | 2組 |
| AXE表記 | AX₂E₂(A: S、X: H、E: 孤立電子対) |
| 立体配置 | 四面体(電子対が占める空間) |
| 見かけの形 | 折れ線形(Bent) |
| H–S–H 結合角 | 約 92.1°(水 H₂O は約 104.5°) |
| 双極子モーメント | 約 0.97 D(水は約 1.85 D) |
| 沸点 | −59.6 ℃(室温で気体) |
※数値は代表値です。教科書や文献により小数点以下が異なることがあります。
ルイス構造をいっしょに描いてみよう
- 価電子を数える:S は6個、H は各1個。
- S–H 結合を2本描く(Hは1本しか結べません)。
- 残りの電子はSの上で孤立電子対 2組にする。
- AXE法で数えると AX₂E₂ → 立体配置は四面体、見える形は折れ線。
硫化水素(H2S)の折れ線形構造の原因と直線形にならない理由
硫黄原子は6つの価電子をもち、そのうち2つが2つの水素と結合に使われ、残り4つは孤立電子対 2組になります。
孤立電子対は空間を大きく取り、電子対どうしの反発をできるだけ減らす向き(四面体の頂点方向)に配置されます。
その結果、2つのS–H 結合は一直線には並べず、折れ線形(曲がった形)になります。
VSEPR理論による分子形状の解析

VSEPR理論、すなわち原子価殻電子対反発理論は、分子の形状を理解するための基本モデルとして用いられます。
この理論は、中心原子周りの電子対がお互いに最少の反発を避ける配置をとることで分子の形状が決まると説明しています。
VSEPR理論の基本原則
電子対の反発: 分子の形状を最も影響するのは、中心原子周りの電子対の反発力です。負の電荷を持つこれらの電子対は、互いにできるだけ距離を置いて配置されます。
反発力の階層: 非共有電子対同士の反発が最も強く、次に非共有電子対と共有電子対の反発、そして共有電子対同士の反発が最も弱いです。
立体数の概念: 立体数は、中心原子に結合している原子の数と非共有電子対の数の合計で、これにより分子の基本的な形状が決定されます。
分子形状の予測とVSEPR理論の適用
VSEPR理論を用いると、中心原子の結合状況と電子対の配置を基に分子の形状を予測できます。
例えば、立体数が2であれば電子対は180度配置され直線形の分子が形成され、立体数が4の場合は四面体配置となり、折れ線形の分子が形成されます。
VSEPR理論の制限と実際の応用における課題
VSEPR理論は便利ですが、全てのケースに適用可能ではありません。
特に中心原子と配位子の電気陰性度の違いや配位子の種類により、理論の予測には限界があります。
また、非共有電子対が共有電子対よりも強い反発力を持つ理由の明確な説明も欠けています。
VSEPR理論は単純化されたモデルですが、分子構造を理解する上での基本的な概念であり、化学の多くの分野でその理解が役立ちます。
結合角はいくつ?水との違い
- H₂S: 約 92.1°
- H₂O: 約 104.5°
- 参照:理想四面体は 109.5° ですが、孤立電子対の反発が強いため結合角は小さくなります。さらに、O → S と周期表で下がるほど原子サイズや結合性が変わり、H₂Sの方が角度が小さくなります。
硫化水素分子の形状を決定する電子対の動き

孤立電子対は結合電子対より空間を大きく取りやすく、反発が強めです。
その押し出し効果でS–H結合は曲がり、H₂Sは直線ではなく折れ線になります。
もし孤立電子対が無い場合(例:CO₂)には、左右対称の直線形になりやすく、結果として無極性になりやすい、という対比も理解の助けになります。
なぜ極性?矢印で考えると一瞬で腑に落ちる
- 電気陰性度(目安):S ≈ 2.58、H ≈ 2.20。S の方に電子がやや引き寄せられます。
- 各 S–H 結合には**極性の矢印(双極子)**ができます。
- H₂S は折れ線形なので矢印が完全には打ち消し合わず、分子全体で極性が残ります(双極子モーメント ≈ 0.97 D)。
イメージ:S を頂点にして、左右の H へ伸びる矢印が少しだけ同じ向きに合成される感じです。
直線・折れ線を見分ける3ステップ(実践)
- 孤立電子対がある? → あれば曲がりやすい。
- AXEで数える → AX₂E₂ なら折れ線/AX₂E₀ なら直線が基本。
- 矢印の合成 → 形が対称なら打ち消し、非対称なら極性が残る。
- 例:CO₂(O=C=O)… AX₂E₀、直線、双極子は打ち消し→ 無極性。
- 例:H₂O… AX₂E₂、折れ線、双極子残る→ 極性。
- 例:H₂S… AX₂E₂、折れ線、双極子残る→ 極性。
極性が物性に与える影響(“水ほどではない”理由)
H₂Sは極性分子ですが、強い水素結合をほとんど作れないため、
- 沸点が低い(−59.6 ℃)
- 室温で気体 という性質を示します。極性=高沸点、とは一概に言えない点に注意しましょう。
安全メモ:H₂Sは有毒です。実験や取り扱いは専門の環境と指示に従ってください。
似た分子とさっと比較(一覧)
| 分子 | 形 | 結合角(目安) | 双極子モーメント(目安) | 状態/相互作用の傾向 |
| H₂S | 折れ線 | 約 92.1° | ≈ 0.97 D | 室温で気体。極性はあるが水素結合は弱い |
| H₂O | 折れ線 | 約 104.5° | ≈ 1.85 D | 強い水素結合→高い沸点、液体が安定 |
| CO₂ | 直線 | 180° | 0 D | 無極性。分子間力は主に分散力 |
3問だけ小テスト(○×でサクッと)
- H₂Sは AX₂E₂ である(○/×) → ○
- H₂Sの結合角は水より大きい(○/×) → ×(H₂S ≈ 92.1° < H₂O ≈ 104.5°)
- CO₂は極性分子である(○/×) → ×(直線で双極子が打ち消し)
-png.avif)